推荐产品
公司新闻/正文
「青莲聚焦」单细胞和空间蛋白质组学结合的新方法,揭示肿瘤细胞异质性
人阅读 发布时间:2022-08-03 09:30
随着空间组学技术的发展,空间蛋白质组学也成为目前的热点研究方向。空间蛋白质组学可以获得组织不同于区域内的蛋白特征表达谱,并广泛应用于肿瘤细胞异质性等研究领域。尽管空间蛋白质组学有基于成像和质谱的方法,然而目前的一个关键挑战是将图像与单细胞水平蛋白质丰度测量联系起来。
2022年,05月19日,蛋白质组学领域大咖Matthias Mann团队在国际著名学术期刊Nature Biotechnology(IF:36.558)上发表了题为“Deep Visual Proteomics defines single-cell identity and heterogeneity”的研究论文。该研究介绍了深度视觉蛋白质组学(DVP),它将人工智能驱动的细胞表型图像分析与自动化单细胞或单核激光显微切割和超高灵敏度质谱相结合。DVP将蛋白质丰度与复杂的细胞或亚细胞表型联系起来,同时保留空间背景。并首次利用DVP技术揭示了正常黑素细胞转变为完全侵袭性黑色素瘤时空间分辨的蛋白质组变化,揭示了随着癌症进展在空间上发生变化的途径。DVP在组织环境中保留精确的空间蛋白质组信息的能力对临床样本的分子图谱具有重要意义。
文章研究思路
DVP工作流程
深度视觉蛋白质组学(DVP)是将亚微米分辨率成像、基于人工智能(AI)的单细胞表型图像分析和单细胞分离与超灵敏的蛋白质组学工作流程相结合(图1)的新技术。其工作流程是:首先利用显微技术生成高分辨率组织图谱;其次利用机器学习与人工智能(AI)方法对细胞类型进行精确分类;然后利用激光显微切割捕获单细胞;最后利用质谱分析特定类型的细胞样本。随后的生物信息学数据分析通过数据挖掘能够发现蛋白质组特征,在单细胞水平上提供对健康和疾病状态中蛋白质组变化的分子洞察。
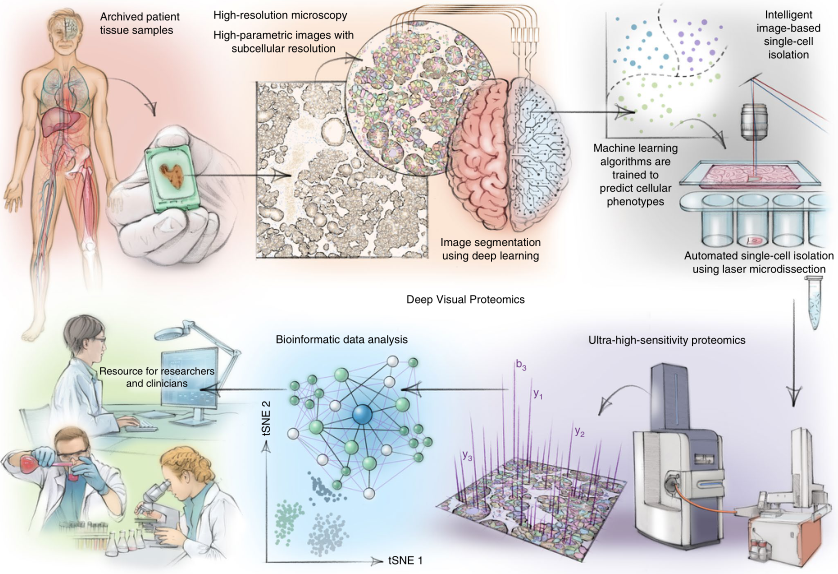
图1. DVP工作流程
研究结果
01用于细胞类型分辨蛋白质组学的图像引导单细胞分离
首先使用扫描显微镜来获得高分辨率的全幻灯片图像,同时作者开发了一个用于综合图像分析的软件套件,称为“BIAS”。它结合了图像预处理、基于深度学习(DL)的图像分割、特征提取和基于机器学习(ML)的表型分类,可实现高准确性的分割感兴趣的细胞区室(图2a-b)。为探索DVP工作流程的敏感性、特异性和稳健性,将其应用于正常人类输卵管组织,并使用细胞谱系特异性转录因子FOXJ1来分离纤毛细胞,并对其进行蛋白质组学分析(图2e-h)。检测到5,000多种可定量蛋白,蛋白质丰度差异分析反映了不同细胞类型的生物学特征。

图2. BIAS用于综合图像分析和自动LMD单细胞分离
02DVP定义亚细胞水平的单细胞异质性
将DVP工作流程应用于未受干扰的癌细胞系,以确定DVP是否可以表征表面相似细胞之间的功能异质性。基于DL算法进行细胞核和细胞膜检测分割后,每个表型分离到80-100个单细胞和250-300个细胞核(图3a-b)。使用超低量样品处理工作流程,直接在384孔板中处理样品,它省略了任何样品转移步骤并确保在非常低的体积下进行样本前处理,并结合高灵敏度质谱进行数据采集。细胞和细胞核蛋白质组显示出很高的定量重现性(Pearson r = 0.96),并且整个细胞的蛋白质组与单独细胞核不同。GO富集分析显示,质膜、线粒体、核小体和转录因子复合物等条目显著富集(图3c)。此外,基于单细胞蛋白质组还发现了几种未表征的蛋白质,并预测了其潜在细胞功能。基于人类病理学图谱研究了C7orf50,结果显示其高表达与胰腺癌的良好预后相关(图3g,P<0.001)。生物信息学分析还揭示了其与蛋白LYAR(细胞生长调节核蛋白)的相互作用、共表达和共定位,表明其与细胞增殖有功能联系(图3f-h)。
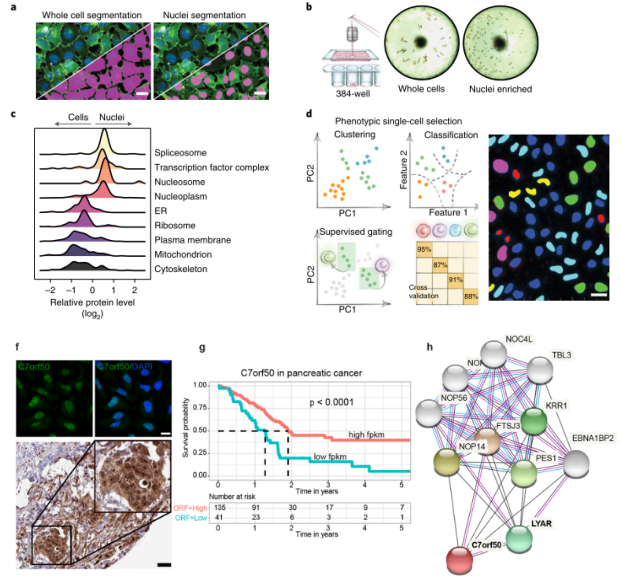
图3. DVP定义了亚细胞水平的单细胞异质性
03DVP应用于癌组织异质性
最后,研究人员将DVP应用于唾液腺腺泡细胞癌和黑色素瘤患者的FFPE组织,以探究肿瘤组织的空间异质性。运用DVP技术对正常组织和腺泡细胞癌组织进行了蛋白质组学分析(图4c)。相关性分析显示正常细胞和癌细胞具有较低的相关性,反映了疾病特异性和细胞类型特异性蛋白质组的变化(Pearson r = 0.8;图4d、e)。腺泡细胞癌中的腺泡细胞标志物显著下调,这也与之前的报道一致。此外,干扰素反应蛋白(例如,MX1和HLA-A)和原癌基因SRC上调,它们都是可操作的治疗靶点(图4e)。作者还使用了IHC分析在正常和癌变组织中证实了蛋白质组学的发现(图4f)。结果证明了DVP方法的特异性和可靠性。
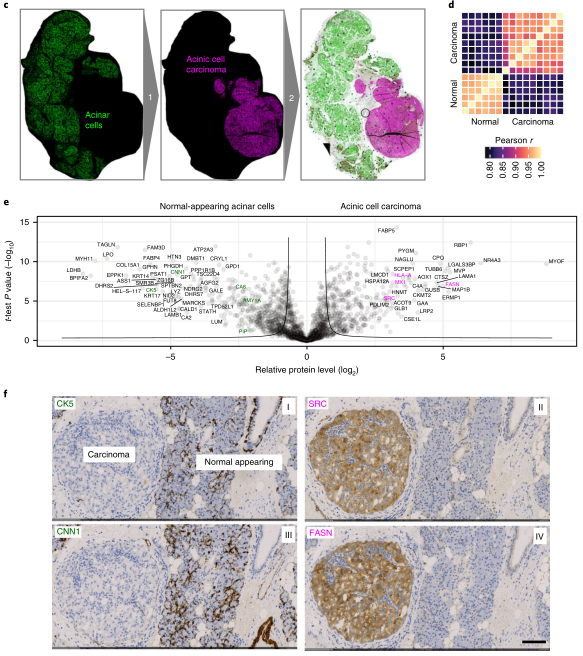
图4. DVP在唾液腺腺泡细胞癌组织中的应用
运用DVP技术研究空间分辨的黑色素瘤进展的不同细胞表型的蛋白质组变化(图5a、b)。采用两种标志物SOX10和CD146共同染色原发性肿瘤FFPE样本,以绘制黑色素瘤细胞图谱。使用CD146作为疾病进展标志物,基于ML算法预测了五个具有明确空间分布的细胞群:1)原位黑色素瘤;2)主要是肿瘤;3)肿瘤微环境细胞;4)CD146高表达区域;5)CD146低表达区域(图5c)。蛋白质组学分析显示了生物学重复之间的高定量重现性,疾病状态和区域特异性蛋白质组(图5e-g)。参与氧化磷酸化和线粒体功能的蛋白质的表达从黑色素细胞、原位黑色素瘤到侵袭性黑色素瘤逐渐增加,表明了晚期肿瘤阶段对线粒体呼吸的依赖性(图5h-j)。相反,与原位黑色素瘤相比,参与抗原呈递和干扰素反应的蛋白质被下调(图5h-j),符合黑色素瘤的免疫逃逸策略。
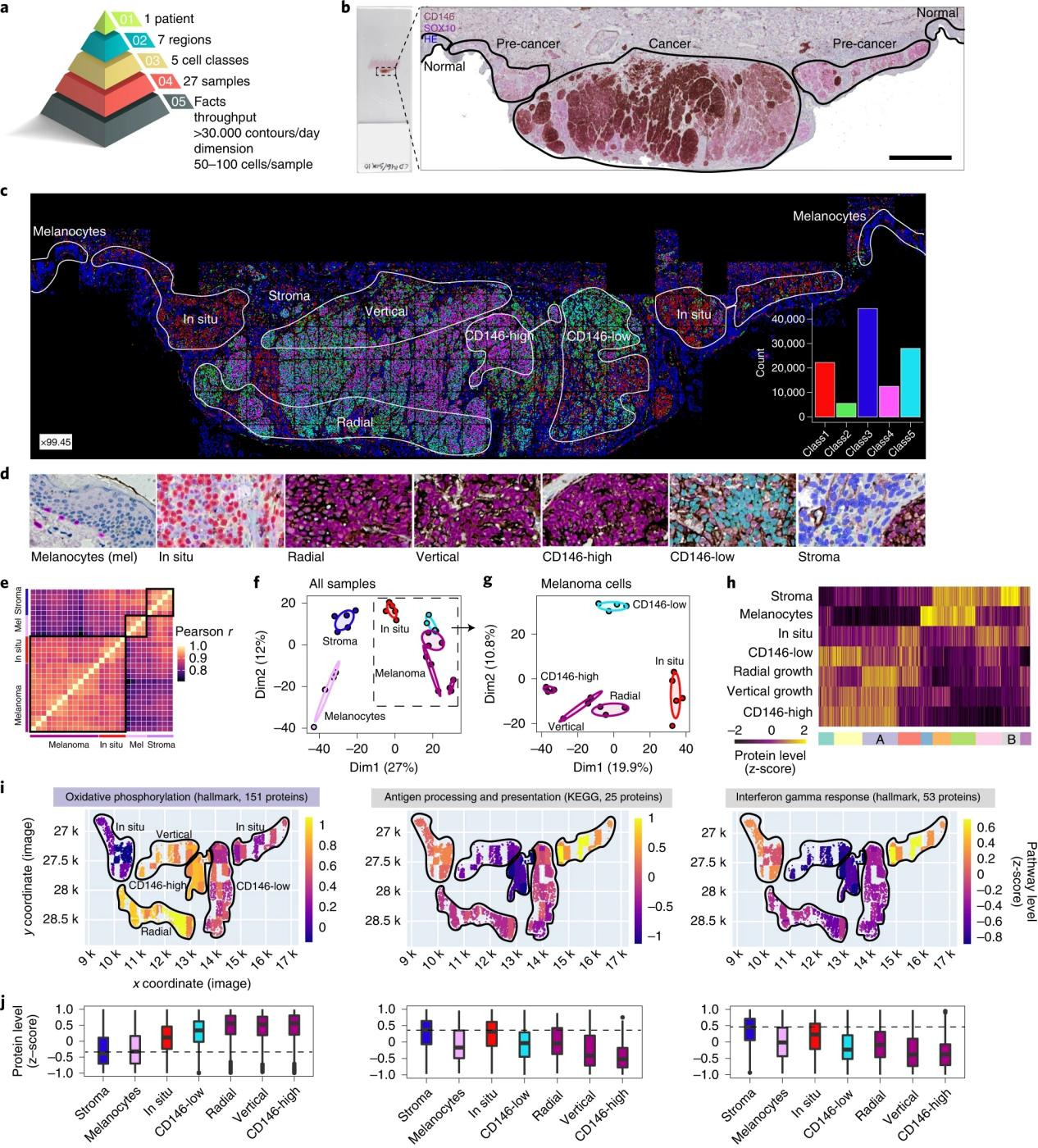
图5. DVP在原发性黑色素瘤组织中的应用
总结
DVP将成像技术与无偏见的蛋白质组学相结合,以量化给定细胞中表达的蛋白,绘制组织或细胞类型特异性蛋白质组图谱,揭示驱动肿瘤进化的机制以及肿瘤的治疗靶点。DVP 技术不仅可以用于癌症的诊断分析,还可以应用其他疾病。与单细胞转录组相比,DVP 可以很容易地分析细胞外基质(ECM)的亚细胞结构和空间动力学。此外,随着蛋白质组学技术的进一步发展,DVP也将适用于在单细胞类型水平上研究蛋白质形式和翻译后修饰。
文章亮点
该研究首次将四种不同技术整合到一个工作流程中,基于显微成像、人工智能、显微切割和质谱分析开发了一项新的蛋白质组学分析技术——深度视觉蛋白质组学(DVP),该技术可以在组织环境中保留精确空间蛋白质组信息的能力,对临床样本的分子图谱研究具有重要意义。
深层视觉蛋白质组学定义单细胞特性和异质性期刊名称:Nature Biotechnology影响因子:36.558样本选择:皮肤组织技术策略:深度视觉蛋白质组学(DVP)