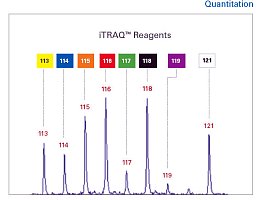
推荐产品
公司新闻/正文
「青莲聚焦」蛋白质组学助力肿瘤前沿热点-小分子抑制剂
人阅读 发布时间:2022-11-15 17:18
抑制剂是一类能够与蛋白相互作用,并降低靶蛋白生物活性的分子,包括酶抑制剂、 转录因子抑制剂、离子通道阻断剂等。生物上的小分子抑制剂一般指的是酶抑制剂,是能够靶向作用于蛋白,降低蛋白活性或者阻碍生化反应的有机化合物分子。临床上使用的大多数药物,其主要成分均为小分子抑制剂。
那么,接下来就跟着小编一起看看小分子抑制剂在肿瘤方面的研究思路吧~

研究成果定量蛋白质组学分析PDAC中对KRASi的适应机制
研究人员使用TMT蛋白质组学技术比较两种不同KRASi在PDAC细胞系MiaPaCa-2中不同时间点(1 h, 4 h, 24 h, 72 h,7天和8周)诱导的蛋白质变化并进一步对24h和7天的蛋白质组进行GSEA分析来研究短期和长期 KRASi处理引起的细胞内通路改变。结果表明KRASi触发了几种代谢途径的代偿性激活,通过靶向代谢组学进一步验证在24 h时,KRASi显示糖酵解、非氧化性PPP和核苷酸代谢下调。有趣的是,尽管正在进行KRASi治疗,这些通路在长期内都被重新激活,表明机制重新参与相同的代谢依赖以帮助增殖。
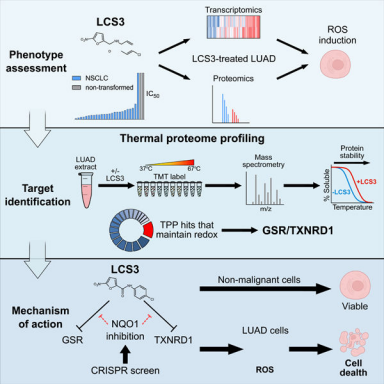
 研究人员发现了一种被称为LCS3的化合物,它选择性地损害人肺腺癌(LUAD)细胞的生长、诱导氧化应激。为了确定介导这种效应的靶点,研究人员利用热蛋白质组分析并发现二硫化物还原酶GSR和TXNRD1作为靶点。酶学分析证实LCS3通过一种可逆的、非竞争性的机制来抑制二硫化物还原酶的活性。CRISPR全基因组筛选确定NQO1缺失是LCS3耐药性的一种机制。
研究人员发现了一种被称为LCS3的化合物,它选择性地损害人肺腺癌(LUAD)细胞的生长、诱导氧化应激。为了确定介导这种效应的靶点,研究人员利用热蛋白质组分析并发现二硫化物还原酶GSR和TXNRD1作为靶点。酶学分析证实LCS3通过一种可逆的、非竞争性的机制来抑制二硫化物还原酶的活性。CRISPR全基因组筛选确定NQO1缺失是LCS3耐药性的一种机制。
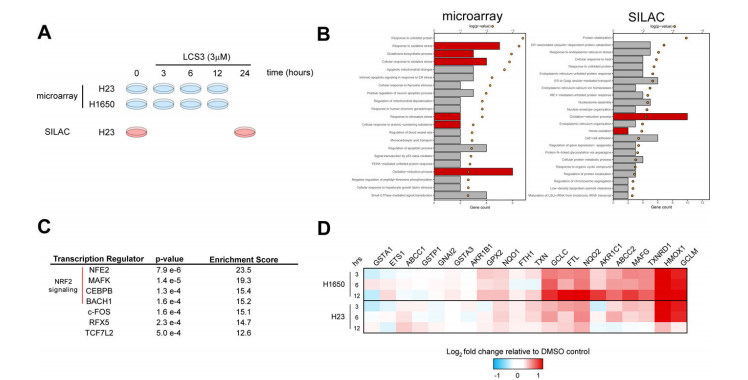
研究成果LCS3诱导ROS和NRF2通路的激活RNA微阵列及SLIAC蛋白组学GO分析结果表明LCS3引起细胞对氧化应激的反应,包括对活性氧(ROS)水平升高有反应的通路。富集分析的结果表明预测的LCS3诱导的转录组变化的前四个上游效应因子都是细胞对氧化应激的反应至关重要的蛋白。这些调控因子包括括MAFK、CEBPB和BACH1,每个都在NRF2的转录激活中作为辅助因子,NRF2是调控细胞ROS反应的重要转录因子。
文献二:使用定量时间蛋白质组学分析KRASG12C抑制剂的耐药机制期刊名称:Cell Reports影响因子:8.109样本选择:LCS3处理的LUAD细胞系技术策略:转录组学、SLIAC蛋白组学、热蛋白质组学、全基因组
那么,接下来就跟着小编一起看看小分子抑制剂在肿瘤方面的研究思路吧~
文献一
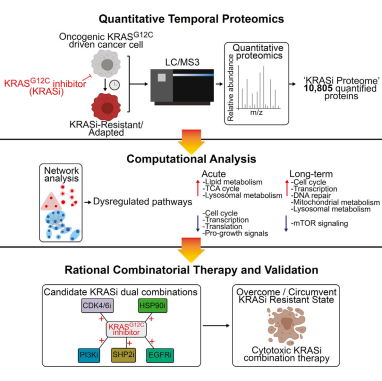
第 一篇是由美国Dana-Farber癌症研究中心的Joseph Mancias教授团队发表在Cell Reports上“Defifining and Targeting Adaptations to Oncogenic KRASG12C Inhibition Using Quantitative Temporal Proteomics”,研究人员运用TMT定量蛋白质组学,对目前正在接受临床试验评估的新开发KRASG12C抑制剂的耐药机制展开了深入研究。

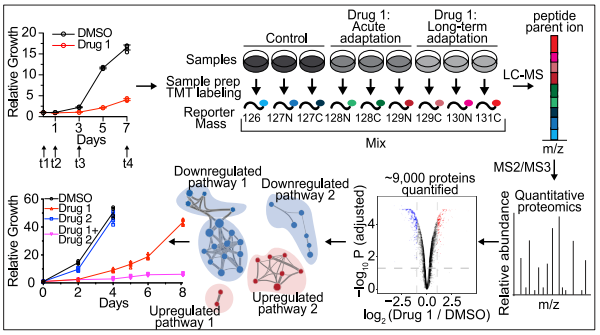
KRASG12C癌蛋白的共价抑制剂近些年已经被陆续开发出来并在临床试验进行了评估,但众所周知靶向疗法的耐药性很常见,可能会限制住KRAS抑制剂(KRASi)的长期疗效。为了确定KRASi的适应途径,并预测规避耐药性的药物组合,研究人员使用基于质谱法的定量时空蛋白组学方法对胰腺癌和肺癌的2D和3D细胞模型中KRASi的蛋白组学进行了表征。

图1:文章摘要
实验设计本研究利用TMT定量蛋白组学技术比较了不同肿瘤细胞系(胰腺癌,肺癌)、不同细胞培养条件(2D,3D)以及加入不同KARS抑制剂(ARS-1620, compound 4)不同时间点引起的蛋白质组差异变化,全面表征了KRASG12C突变肿瘤细胞对KARSi的适应性机制。
研究成果定量蛋白质组学分析PDAC中对KRASi的适应机制
研究人员使用TMT蛋白质组学技术比较两种不同KRASi在PDAC细胞系MiaPaCa-2中不同时间点(1 h, 4 h, 24 h, 72 h,7天和8周)诱导的蛋白质变化并进一步对24h和7天的蛋白质组进行GSEA分析来研究短期和长期 KRASi处理引起的细胞内通路改变。结果表明KRASi触发了几种代谢途径的代偿性激活,通过靶向代谢组学进一步验证在24 h时,KRASi显示糖酵解、非氧化性PPP和核苷酸代谢下调。有趣的是,尽管正在进行KRASi治疗,这些通路在长期内都被重新激活,表明机制重新参与相同的代谢依赖以帮助增殖。

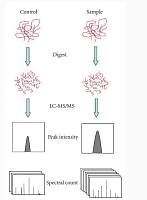
图2:定量蛋白质组学及生信分析流程
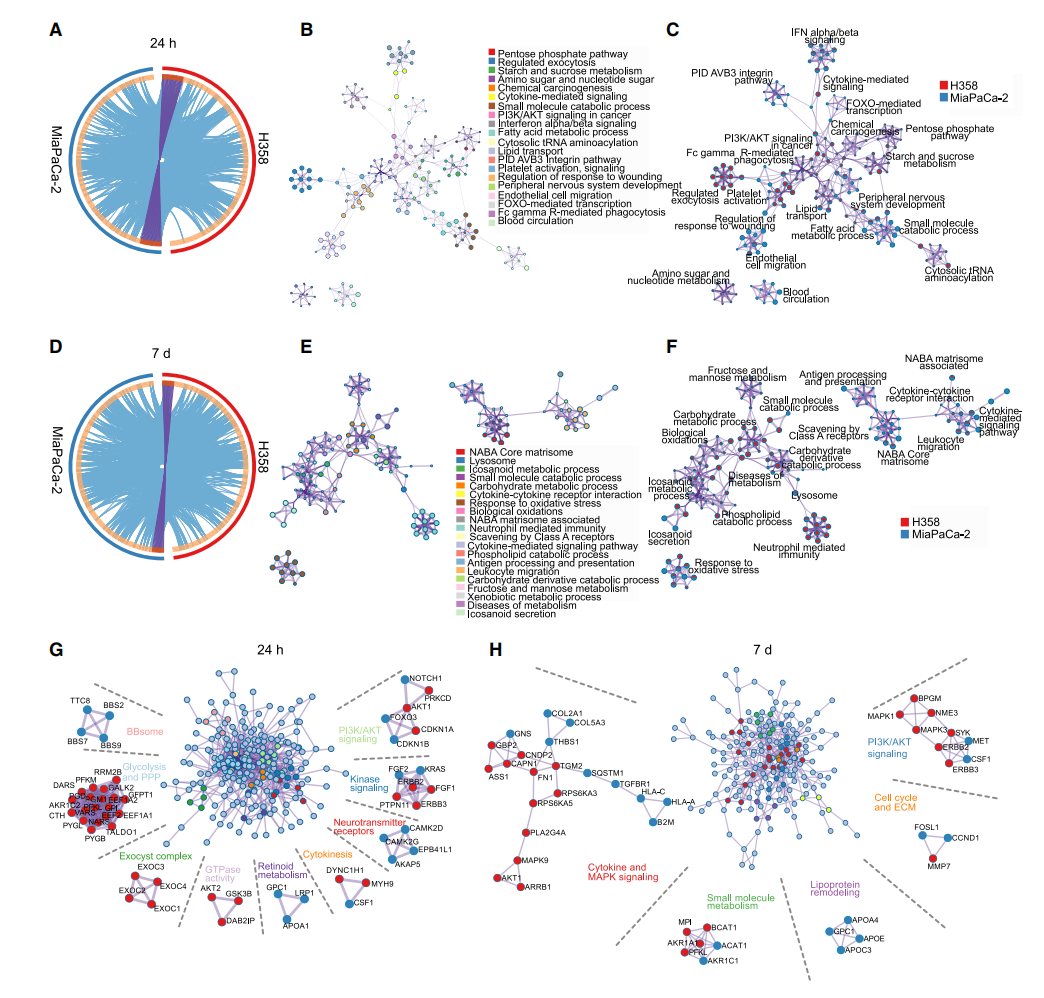
定量蛋白质组学分析NSCLC中对KRASi的适应机制研究人员通过对KRASi短期(24h)和长期(7天)诱导的NSCLC细胞系H358进行了蛋白质组学分析。GSEA分析发现了与PDAC细胞系中类似的通路富集。对前300种上调的蛋白(24小时和7天)进行通路富集分析、PPI分析和聚类分析,两种细胞系中上调的通路存在相似性。在24h时间点,细胞系之间重叠功能的分析包括: 代谢(PPP和脂质代谢)、细胞因子信号传导和PI3K / AKT信号传导途径的激活;而在7天时间点,长期适应与改变有关的主要是:抗原呈递、对氧化应激的反应和溶酶体途径。

图3:不同癌症类型的KRASi蛋白质组显示出相似的通路富集
此外,研究人员还对用KRASi处理72小时(2D,10 mM;3D,0.5 mM)的HCC44细胞进行了蛋白质组学分析,与2D相比,3D中的KRASi诱导了更多的显著蛋白质组变化。基于这些蛋白质组数据并结合细胞实验,研究人员确定了KRASi与磷脂酰肌醇3-激酶(PI3K)、HSP90、CDK4/6、CDK4/6和SHP2抑制剂的有效组合,在某些情况下可以将KRASi单药治疗的细胞毒性反应转化为联合治疗的细胞毒性反应。
文献二
另一篇是由温哥华BC癌症研究所William W. Lockwood团队发表在Cell Reports上“Characterization of a small molecule inhibitor of disulfide reductases that induces oxidative stress and lethality in lung cancer cells”。研究人员利用热蛋白质组分析(TPP)来表征肺腺癌小分子抑制剂LCS3的作用机制。并证明LCS3抑制二硫化物还原酶使肺腺癌细胞对活性氧(ROS)和细胞死亡敏感。


图1:文章摘要
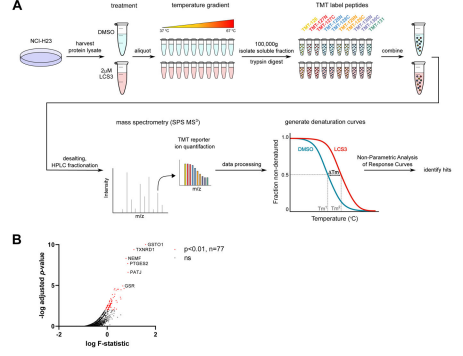
实验设计LUAD细胞系H23 (KRAS突变体)和H1650(EGFR突变体)用3µM LCS3处理3、6和12小时并在每个时间点进行RNA微阵列、处理24小时进行SLIAC蛋白组分析,使用热蛋白质组鉴定了H23细胞裂解液中与LCS3形成热稳定复合物的蛋白质,之后对LCS3敏感的H358细胞系进行了CRISPR全基因组筛选。
研究成果LCS3诱导ROS和NRF2通路的激活RNA微阵列及SLIAC蛋白组学GO分析结果表明LCS3引起细胞对氧化应激的反应,包括对活性氧(ROS)水平升高有反应的通路。富集分析的结果表明预测的LCS3诱导的转录组变化的前四个上游效应因子都是细胞对氧化应激的反应至关重要的蛋白。这些调控因子包括括MAFK、CEBPB和BACH1,每个都在NRF2的转录激活中作为辅助因子,NRF2是调控细胞ROS反应的重要转录因子。

图2:LCS3诱导ROS和NRF2通路的激活
热蛋白质组学分析确定氧化还原调节蛋白是LCS3的潜在靶点确定了细胞对LCS3的反应包括细胞凋亡和氧化应激后,研究人员利用TPP确定LCS3的分子靶点。共检测到5593个蛋白,采用NPARC分析,根据与LCS3形成热稳定配合物的能力对它们进行排序,该策略优先考虑了77种参与多种细胞功能的蛋白质。鉴于LCS3处理后观察到的氧化应激,效应靶蛋白可能也属于这一功能类。之后根据其这一类别中排名较高且热稳定较大的3个候选蛋白GSTO11、TXNRD1以及GSR作为LCS3的潜在靶点进一步研究。

图3:热蛋白质组分析(TPP)鉴定介导氧化还原稳态的候选LCS3互作蛋白
进一步通过酶学分析,结果表明谷胱甘肽二硫化物还原酶(GSR)和硫氧还蛋白还原酶1 (TXNRD1)是LCS3的靶点,抑制这两种酶可协同诱导细胞凋亡。 文献一:诱导肺腺癌细胞氧化应激和凋亡的二硫化物还原酶的小分子抑制剂特征研究期刊名称:Cell Reports影响因子:8.109样本选择:KARSi处理的肿瘤细胞系技术策略:TMT蛋白质组学、靶向代谢组学、磷酸化蛋白组
文献二:使用定量时间蛋白质组学分析KRASG12C抑制剂的耐药机制期刊名称:Cell Reports影响因子:8.109样本选择:LCS3处理的LUAD细胞系技术策略:转录组学、SLIAC蛋白组学、热蛋白质组学、全基因组