推荐产品
公司新闻/正文
「青莲聚焦」结直肠癌多组学研究新发现
人阅读 发布时间:2023-02-03 09:47

标题:Integrated multi-omics characterization of KRAS mutant colorectal cancer.
期刊:Theranostics(IF =11.556)
时间:2022.12
背景
结直肠癌(CRC)是全球第四大致命恶性肿瘤,在新病例方面排名第三,是全球癌症相关死亡的第二大原因。被广泛认为是一种异质性疾病,其发病机制涉及多种基因改变和多种途径。KRAS突变是结直肠癌(CRC)中最常见的致癌畸变。一旦KRAS突变发生,KRAS中的GTP-GDP循环会被破坏导致突变KRAS蛋白以活性状态积累从而激活下游MAPK和PI3K信号联级,从而促进肿瘤细胞增殖和存活。现已知致癌KRAS突变介导肿瘤微环境(TME),特别是通过促进炎症和抑制免疫反应最终导致免疫逃避和肿瘤进展。然而,TME中细胞异质性的景观尚未在具有KRAS突变的CRC中得到很好的表征,仍有待研究。以前对KRAS突变癌症的大规模组学研究极大地促进了对KRAS驱动癌症分子多样性的理解。到目前为止,主要还是基于基因组学和转录组学。最近的研究表明了蛋白质组学和磷酸化蛋白质组学表征在促进肿瘤异质性理解方面的重要性。除了加强或补充转录组学数据外,蛋白质基因组学数据的整合还可以纠正基于转录组学数据的不准确推断,从而得到意想不到的发现和治疗机会。
文章重点
整合多组学(基因组、转录组、蛋白质组、磷酸组等)数据,全面表征KRAS突变型CRC分子网络和生物异质性,细化KRAS突变型CRC的分子分层,有助于开发更适合KRAS突变型(KRAS-Mut)CRC的联合疗法。报道了KRAS突变的CRC肿瘤可以分为两种不同的分子亚型,研究基于整合的转录组,蛋白质组学和磷酸化蛋白质组学分析,而不是基于突变的残基。两种亚型的特征在于不同的临床特征、生物学途径、拷贝数改变和与KRAS信号激活相关的磷酸化级联反应。激酶网络分析和药物敏感性预测也揭示了可能有助于治疗特定亚型的潜在治疗药物。总体而言,这些蛋白质基因组学分析为KRAS突变CRC肿瘤的生物学发现和治疗开发提供了新的途径。研究内容
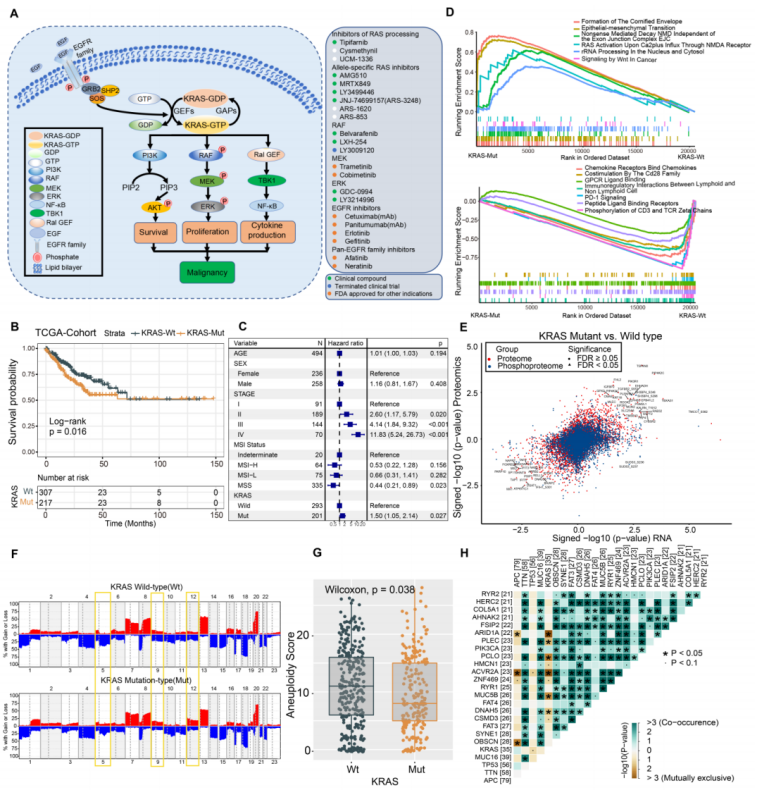
1.KRAS突变体与KRAS野生型结直肠癌的分子比较作者总结了KRAS激活信号通路和每个节点的相关抑制因子(图1A)。可知KRAS发生突变,KRAS中的GTP-GDP循环会被破坏导致突变KRAS蛋白以活性状态积累从而激活下游MAPK和PI3K信号联级,进而导致细胞增殖和存活。对CRC患者的预后生存分析显示,KRAS-Mut患者的预后较差(图1B),在校正了年龄、性别、临床分期和MSI状态后,在多种变量回归模型中,这种相关性仍然显著(图1C)。GSEA分析表明,KRAS-Mut患者的致癌信号通路富集程度更高,KRAS野生型(KRAS-WT)患者的趋化因子受体结合趋化因子的富集程度更高(图1D)。接下来,基于转录组学、蛋白质组学和磷酸化蛋白质组学数据,对KRAS-Mut和KRAS-WT CRC的整体差异调控进行了比较。其中KRAS-Mut组肿瘤迁移和PI3K/AKT激活显著上调,而KRAS-WT组免疫调节和细胞代谢显著上调(图1E)。基于基因组学,体细胞拷贝数变异(SCNAs)和非整倍性打分分析表明,KRAS-Mut组均表现出较低水平的改变(图1F,G)。KRAS突变与CRC中25个最常见的突变基因之间的关系如图1H所示,CRC中RID1A和ACVR2A突变与KRAS突变相互排斥,进一步提示CRC中存在遗传畸变。
02.KRAS-Mut结直肠癌的单细胞转录组景观
基于bulk RNA-seq数据使用xCell算法分析转录组数据来研究基质细胞和免疫细胞的浸润水平和CRC中细胞亚群的变化。大部分细胞亚群在KRAS-Mut和KRAS-WT肿瘤之间存在显著差异。KRAS-Mut的上皮细胞和Treg细胞较多而KRAS-WT的CD4+ 细胞,巨噬细胞和pDCs较多(图2A)。从16个KRAS-WT和13个KRAS-Mut的CRC中共获得55539个单细胞鉴定出6种主要细胞类型(图2B)。其中T细胞,B细胞,髓样细胞和基质细胞在KRAS-Mut和KRAS-WT中的分布存在显著差异。对这4类细胞进一步聚类分别鉴定到8个,5个,8个和11个细胞亚群。KRAS-WT中CD4+ T细胞,CD8+ T细胞和调节性T细胞亚群的分布较多,而KRAS-Mut中IgG+浆细胞,SPP1+巨噬细胞和肌成纤维细胞亚群的分别较多(图2C和2D)。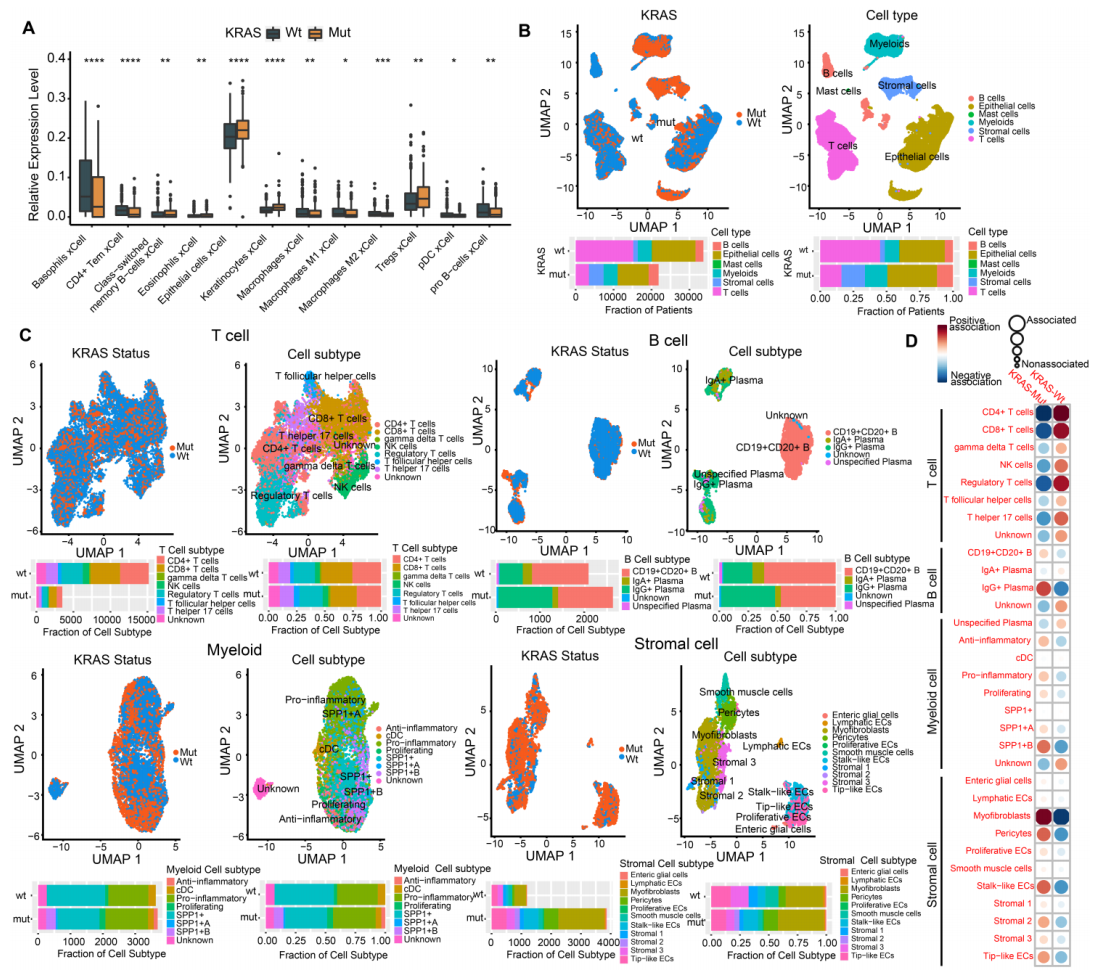
03.鉴定KRAS-Mut亚群的分子亚型
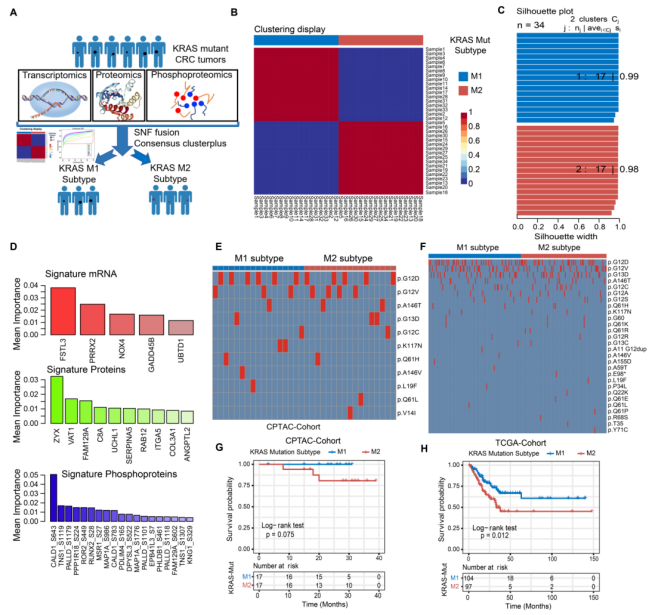
进一步整合了来自CPTAC数据集的公开转录组,蛋白质组学和磷酸化蛋白质组学数据,以研究KRAS-Mut肿瘤的共识分子亚型和治疗脆弱性。KRAS-Mut CRC被分为两个亚型KM1和KM2(图3A,B)。同时作者也分别在三个组学的数据集进行了无监督聚类分析,结果显示整合三种组学数据可以更准确地对KRAS-Mut CRC进行分类(图3C)。为了识别KM1和KM2亚型之间最具鉴别性的分子特征,使用随机森林方法分别在mRNA、蛋白和磷酸化蛋白水平上筛选出5个mRNA、10个蛋白和19个磷酸化蛋白作为分型特征因子(图3D)。作者进一步比较了KRAS中的突变残基,KM1和KM2亚组之间的差异无统计学意义(图3E,F)。KM1与KM2亚组相比,患者有更好预后(图3G,H)。

04.KRAS-Mut 结直肠癌的肿瘤基因组变异
作者进一步分析了KRAS-Mut CRC患者的基因组景观。对CPTAC和TCGA队列进行SMG分析。结果显示ARID1A和BRAF在KRAS-WT组中的突变率高于KRAS-Mut组(图4A)。TCGA队列中,KRAS-Mut的APC和PCBP1突变频率高于KRAS-WT。CRC肿瘤中KM1、KM2和KRAS-WT中单核苷酸变异存在差异(图4B),提示在KRAS突变的异质性中存在特定的突变过程。随后,作者从基因组数据中提取了5个突变特征(图4C),突变计数和CNA的基因组改变在KM1、KM2和KRAS-WT亚型肿瘤中具有显著差异(图4D,E)。
05.具有特定临床特征和分子过程的KRAS突变模式
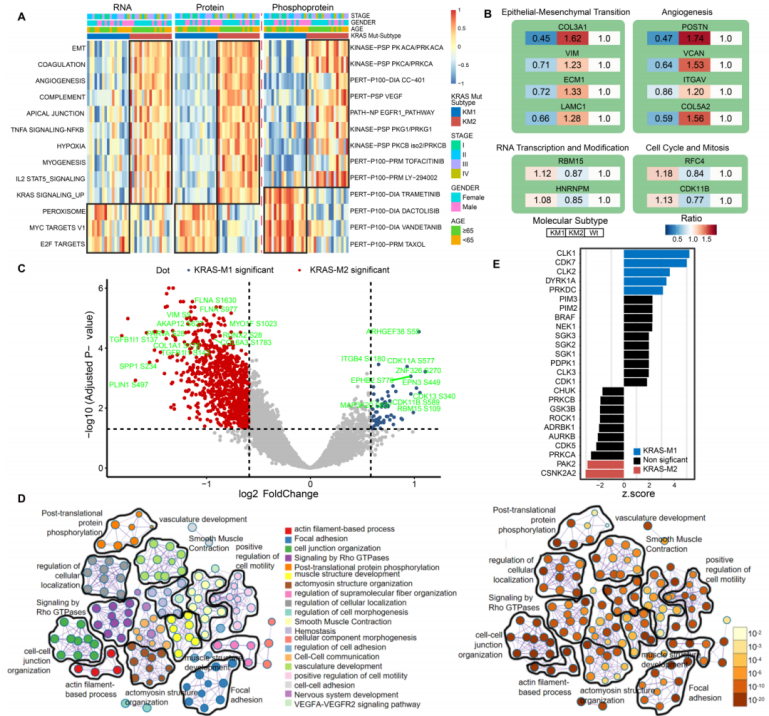
作者进一步探讨CRC肿瘤中KRAS突变模式与临床特征和分子亚型的关系。KRAS突变亚型的前50个差异表达mRNA转录本,蛋白质和磷酸蛋白显示在热图中。发现所有的MSI阳性肿瘤都聚集在KRAS-WT亚组中,并导致了高突变表型、MSI和免疫相关的CMS1转录组亚型的聚集和BRAF、ARID1A突变。KM2与肿瘤晚期、间充质表型、CMS4转录组亚、ProS-C蛋白质组亚型和免疫亚型2相关,提示间质浸润、血管生成和预后较差。KM1亚型主要表现为肿瘤早期、CIN表型、上皮细胞和代谢相关的CMS3转录组亚型、ProS-E蛋白质组亚型和免疫亚型1(图5A,B)。TCGA队列的结果与之一致(图5C)。肿瘤生物学特征分析表明,在CPTAC队列中,KM2亚型的巨噬细胞,MDSCs,缺氧特征,EMT特征和基质打分最高(图5D)。xCELL算法分析表明KM2亚型的MSCs,脂肪细胞和M2巨噬细胞等较多而KM1亚型的记忆B细胞和NK细胞较多(图5E)。亚型间富集的生物过程和免疫浸润也具有显著差异(图5D,E)。

06.通过蛋白质组学和磷酸化蛋白质组学分析对KRAS突变模式进行功能注释
作者对KM1和KM2肿瘤亚型在RNA,蛋白质和磷蛋白水平上进行了功能富集差异分析,以进一步阐明KRAS突变亚型的生物学意义。对KM1和KM2亚型进行ssGSEA分析。KM1亚型中过氧化物酶体,MYC靶点和Wntβ-catenin通路显著富集,KM2亚型中EMT,凝血,血管生成和肌生成显著富集(图6A)。磷蛋白数据集的PTM分析表明,KM2亚型的特征是PKACA,VEGF,PI3K的激酶活性上调,KM1亚型的特征是MEK,PI3K/mTOR和紫杉醇药物靶点上调。此外,EMT过程和血管生成通路的代表蛋白在KM2亚型中显著过表达(图6B),而RBM15和HNRNPM在KM1亚型中显著过表达(图6B)。磷酸化位点表达水平分析表明,KM2亚型中粘附信号相关磷酸化位点FLNA-S1630和MYO1F-S1023和间质表型相关位点VIM-S5,COL1A1-S176和TFB1I1-S143的磷酸化水平显著上调,而KM1亚型中酪氨酸蛋白激酶受体EPHB2-S776和细胞周期相关蛋白CDK11A-S577和CDK13-S432的水平显著上调(图6C)。富集分析表明,肌动蛋白丝状过程,局灶粘附和Rho GTPases信号转导等功能显著富集(图6D)。KM1亚型中,CDC样激酶CLK1/2,细胞周期蛋白依赖激酶CDK1/7和细胞外信号调节激酶MAP1/3显著富集,而KM2亚型中凋亡相关激酶PAK2, PAK5和AKT丝氨酸苏氨酸蛋白激酶显著增加(图6E)。
07.分子特征与药物敏感性之间的相关性分析揭示了KRAS-Mut结直肠癌的亚群特异性疗法
最后作者进一步探讨了KRAS-Mut亚型在CRC中的潜在脆弱性,使用DepMap数据集比较基于大规模RNAi筛选的结直肠癌细胞系的基因依赖性。41个KRAS突变的CRC细胞系被筛选并分类为KM1或KM2亚群。根据小于-0.3的平均依赖性评分作为阈值鉴定到13个依赖评分显著不同的基因(图7A,B)。其中,KM2亚型包括PI3K/AKT信号相关的ZFP36L1和VEGF信号相关的COL5A1和TLN1;KM1亚型具有细胞周期/有丝分裂依赖的CCNB3、RAD21和核心Wnt信号分子CTNNB1。为了进一步鉴定KRAS-Mut CRC亚型的亚群特异性治疗药物,作者在三个药物反应数据库中来研究KM1和KM2细胞亚群的潜在的治疗药物(图7C,D)。最后,作者画了一张总结图来展示KRAS-Mut亚型信号通路,以概述在KRAS-Mut CRC中的发现(图7E)。