北京青莲百奥生物科技有限公司
10 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
重磅 I 青莲MagicOmics EMC细胞外囊泡纯化效率再升级
38 人阅读发布时间:2025-11-19 09:26
细胞外囊泡(EV)作为细胞间通讯的关键介质,作为疾病生物标志物和药物递送载体具有重要意义。然而,与任何自然科学领域一样,对EV的深入研究很大程度上依赖于技术进步。当前EV研究与应用仍面临以下核心痛点:
1、分离纯度低
体液中脂蛋白等杂质浓度较EV高出3-6个数量级,且其物理性质与EV高度相似,导致常规分离方法难以获得高纯度EV;
2、样本量限制
临床可用样本量通常不超过100 μL,在有限样本中实现高效回收面临严峻挑战;
3、标准化缺失
缺乏统一、可靠的分离方案,不同方法间的结果可比性差,严重阻碍了研究成果的临床转化;
4、鉴别能力不足
现有技术难以有效区分EV与病毒、细菌碎片等尺寸相近的生物颗粒,影响下游分析的准确性。
在过去的几十年里,标准化高通量的EV分离方法仍然没有出现,这使得高产量EV分离具有挑战性[1]。
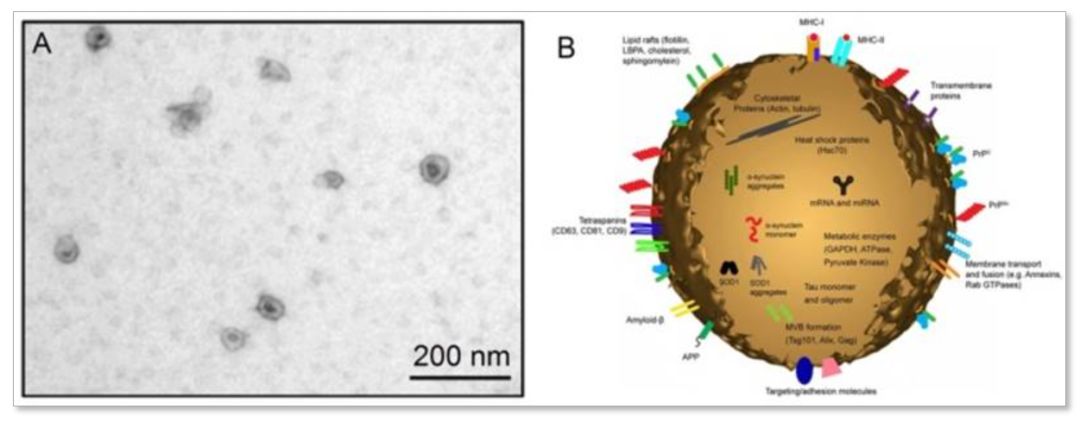
(A)EV的电子显微图像[2]和(B)中等大小EV的图表[3]
到目前为止,已经先后报道了六类EV分离策略,包括超速离心、超滤、免疫亲和捕获、聚合物沉淀、尺寸排阻和微流控技术。
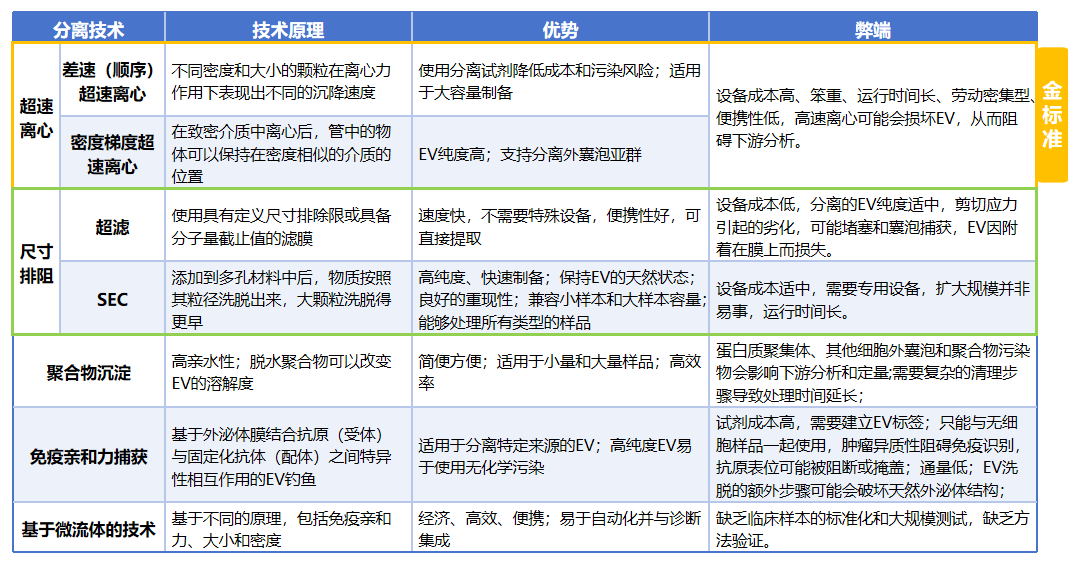
其中,SEC则具有高质量EV制备能力、出色的便携性及重现性。与超离和超滤不同,SEC是通过被动重力流进行的,不影响囊泡的结构和完整性[4]。尽管有诸多优势,但SEC方法也面临着一些挑战。根据最近的一项比较研究,通过SEC柱制备的EV中存在与EV尺寸相似的污染物,如蛋白质聚集体和脂蛋白。适用于多种样品来源的单一方法是不切实际的,因此我们利用EV的不同理化和生化性质,采用创新的组合层析方法,实现对EV的“精准捕获”,一举突破传统局限:
创新技术突破:Magic Omics EMC vs 传统 SEC
传统SEC依赖单一尺寸排阻机制,利用EV与杂质分子的粒径差异实现分离,但脂蛋白(如HDL、LDL)与EV粒径高度重叠,难以有效分离,导致EV制品中残留大量ApoB、ApoE等脂蛋白污染物。
Magic Omics EMC试剂盒通过整合“尺寸排阻+离子交换+复合层析”三重机制形成“筛选-分离-纯化”的三级体系,实现EV的高选择性富集。与单一SEC相比,技术优势体现在:

数据验证
实验设计如下:使用50 μL微量人血浆作为起始样本,分别通过传统尺寸排阻法(SEC)与青莲Magic Omics EMC试剂盒平行处理以分离细胞外囊泡(EV)。
结构表征(TEM)
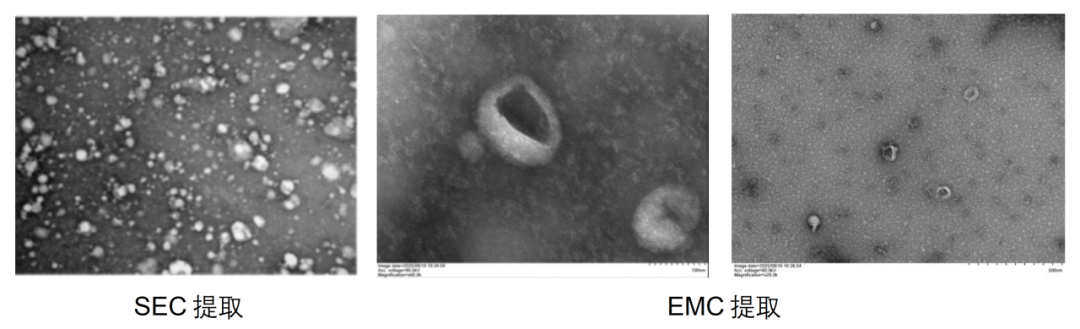
SEC与MagicOmics EMC纯度对比图显示,EMC显著减少杂蛋白
得率与覆盖度验证
胶图结果显示,Magic Omics EMC试剂盒胶图中无明显大分子污染拖尾,显著降低了共分离的杂蛋白,更好地保留了EV的膜蛋白,捕获了更完整的EV内容物。在蛋白质组覆盖度方面,青莲EMC方法的覆盖度最高,采用timsTOF HT 22min DIA 方法进行鉴定分析,通过DIA-NN 1.9.2搜库,结果显示,Magic Omics EMC试剂盒鉴定到3113 PGs,而传统SEC方法仅鉴定到1409PGs,且青莲EMC方法分离的EV独特鉴定出1764种差异蛋白,为后续的生物标志物发现或功能机制研究,提供更为全面和深度的分子图谱。
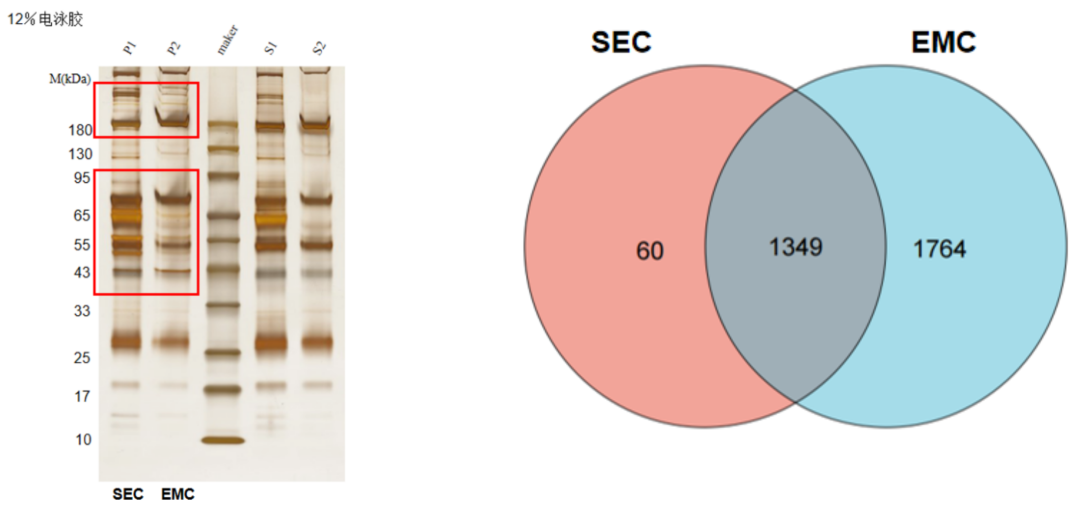
蛋白质组学分析揭示不同方法分离的EV群体差异
纯度与特异性验证
如下图所示,青莲Magic Omics EMC试剂盒富集EV标志蛋白(如CD9、TSG101)的富集倍数与SEC方法存在显著差异,且青莲EMC方法有效降低非特异性杂质干扰,在提取纯度和特异性上全面优于传统SEC方法。
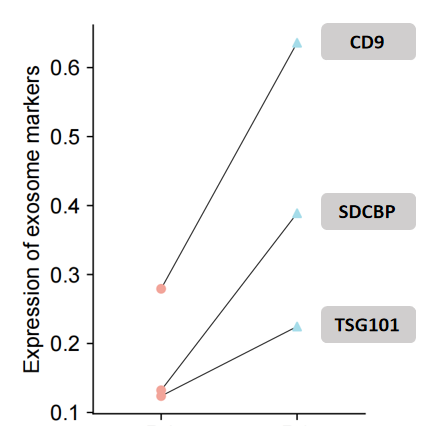
通过检测经典标志物评估EV纯度
Magic Omics EMC试剂盒为EV研究提供标准化、高通量的解决方案。适用于临床大队列样本的蛋白质组学与转录组学分析,为液体活检领域提供新方法论支持。
青莲百奥解决方案
为应对高通量研究与标准化挑战,青莲百奥带来了系统级解决方案:从核心的MagicOmics专利试剂盒,到自主研发的自动化工作站与配套耗材,实现样本前处理流程的智慧化升级,确保数据质量与科研效率的飞跃。针对高通量样本检测、标准化实验流程搭建以及科研成果快速转化的需求,青莲百奥构建“试剂盒+自动化设备+专用耗材”的科学工具全链条体系,为科研工作者提供全方位、一体化专属支持。
工具赋能繁自简,千程万绪亦通途;精研为基质难改,数据分毫不敢疏。——青莲百奥以专业助力,陪您在科研征途中稳步前行、直抵成果。

参考文献
1. Willms E, Cabanas C, Mager I, Wood MJA, Vader P. Extracellular vesicle heterogeneity: subpopulations, isolation techniques, and diverse functions in cancer progression. Front Immunol. 2018;9:738.
2. Lobb RJ, Becker M, Wen SW, Wong CSF, Wiegmans AP, Leimgruber A, Möller A. Optimized exosome isolation protocol for cell culture supernatant and human plasma. J. Extracell. Vesicles. 2015;4:27031
3. Bellingham SA, Guo BB, Coleman BM, Hill AF. Exosomes: vehicles for the transfer of toxic proteins associated with neurodegenerative diseases? Front. Physiol. 2012;3:124
4. Yang D, Zhang W, Zhang H, Zhang F, Chen L, Ma L, Larcher LM, Chen S, Liu N, Zhao Q, Tran PHL, Chen C, Veedu RN, Wang T. Progress, opportunity, and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 2020 Feb 19;10(8):3684-3707.