北京青莲百奥生物科技有限公司
10 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
Adv Sci | 南昌大学王建斌团队:乳酸化与LDHA在肺腺癌化疗耐药中的双向调控
199 人阅读发布时间:2025-11-19 16:23
肿瘤利用Warburg效应(有氧条件下的糖酵解)产生大量的乳酸,并伴随着代谢重编程过程。LDHA是糖酵解中的关键酶,主要负责催化丙酮酸还原为乳酸,但其本身能否被修饰尚未明确。
2025年11月5日,南昌大学第一附属医院王建斌团队在Advanced Science(IF 14.1/Q1)上发表题为“Lactylation Enhances the Activity of Lactate Dehydrogenase A and Promotes the Chemoresistance to Cisplatin Through Facilitating DNA Nonhomologous End Junction in Lung Adenocarcinoma”的研究论文,提出乳酸脱氢酶A(LDHA)本身可作为乳酸化的靶点,其乳酸化修饰能增强酶活性,进而通过正反馈循环促进整体细胞乳酸化水平。更重要的是,这一机制影响了DNA非同源末端连接(NHEJ)修复通路,导致肺腺癌细胞对顺铂化疗产生耐药性。本文将深入解读该研究的思路、结果和意义,带您全面了解这一突破性发现。

研究背景
-
肿瘤细胞瓦博格效应(Warburg effect)导致糖酵解增强,乳酸大量积累。乳酸不仅作为能量底物,还可作为修饰基团参与蛋白质乳酸化,影响基因表达和蛋白功能。
-
LDHA是糖酵解中的关键酶,其翻译后修饰(已知的如乙酰化、琥珀酰化)可调节其活性。
-
DNA损伤修复是肿瘤细胞抵抗化疗的重要机制,尤其是非同源末端连接(NHEJ)通路。
核心问题
-
LDHA本身是否发生乳酸化修饰?
-
乳酸化如何影响LDHA的活性和功能?
-
LDHA乳酸化是否通过调节DNA修复通路影响肺腺癌的化疗敏感性?
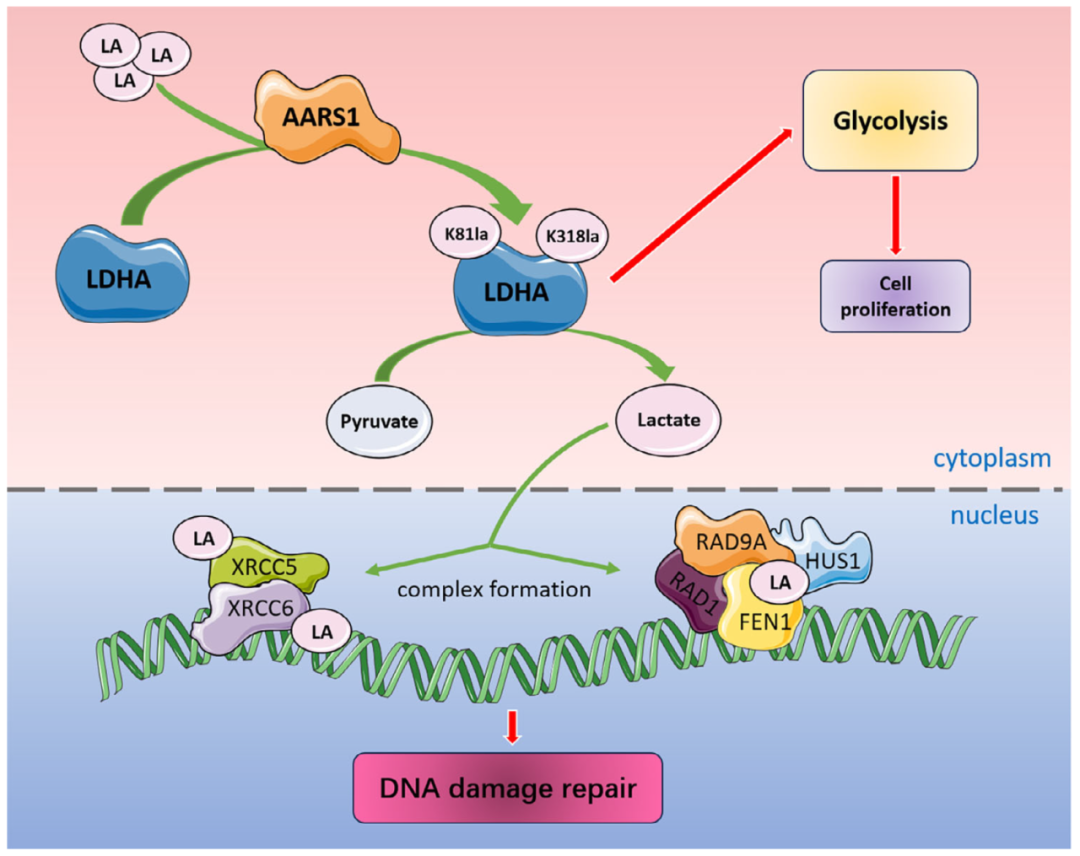
图1. LDHA与乳酸化的双向调控可增强肺癌糖酵解和DNA损伤修复
研究结果
一、从临床现象到科学问题:肺腺癌乳酸化水平升高
研究团队首先从临床实际问题出发,对16例肺腺癌患者的组织样本进行分析。结果发现,癌组织中的整体乳酸化水平显著高于正常组织,这提示乳酸化可能与肺腺癌的发生发展密切相关。
图2. LDHA是驱动肺腺癌乳酸化的关键因素
面对这一现象,研究团队提出了关键问题:在糖酵解过程中,LDHA和LDHB哪个是驱动乳酸化的主要因子?通过相关性分析,他们发现LDHA与乳酸化水平的相关性明显强于LDHB。随后在细胞实验中也验证了这一发现——敲低LDHA能显著降低乳酸化水平,而敲低LDHB则无此效果。这一结果明确了后续研究的主要方向:聚焦LDHA在乳酸化调控中的核心作用。
二、机制探索:LDHA自身的乳酸化修饰及其功能影响
在确定LDHA的重要性后,研究团队开始深入探索其作用机制。他们首先提出一个创新性假设:LDHA本身是否也会发生乳酸化修饰?这一假设基于乳酸化修饰的广泛性特点,但此前从未有研究报道。
通过CoIP实验,研究团队惊喜地发现LDHA确实可以被乳酸化修饰,且这一修饰受到乳酸钠(NaLa)的促进和LDHA抑制剂Oxamate的抑制。更重要的是,他们通过位点突变筛选,鉴定出K81和K318是LDHA的关键乳酸化位点。功能实验结果表明,LDHA的乳酸化修饰并不影响其蛋白稳定性,而是显著增强其酶活性。当研究人员将LDHA的K81和K318位点突变为精氨酸(LDHA-2KR)后,LDHA的催化活性明显降低,导致细胞内乳酸生成减少和丙酮酸积累,说明K81和K318是LDHA关键的酶活性开关。
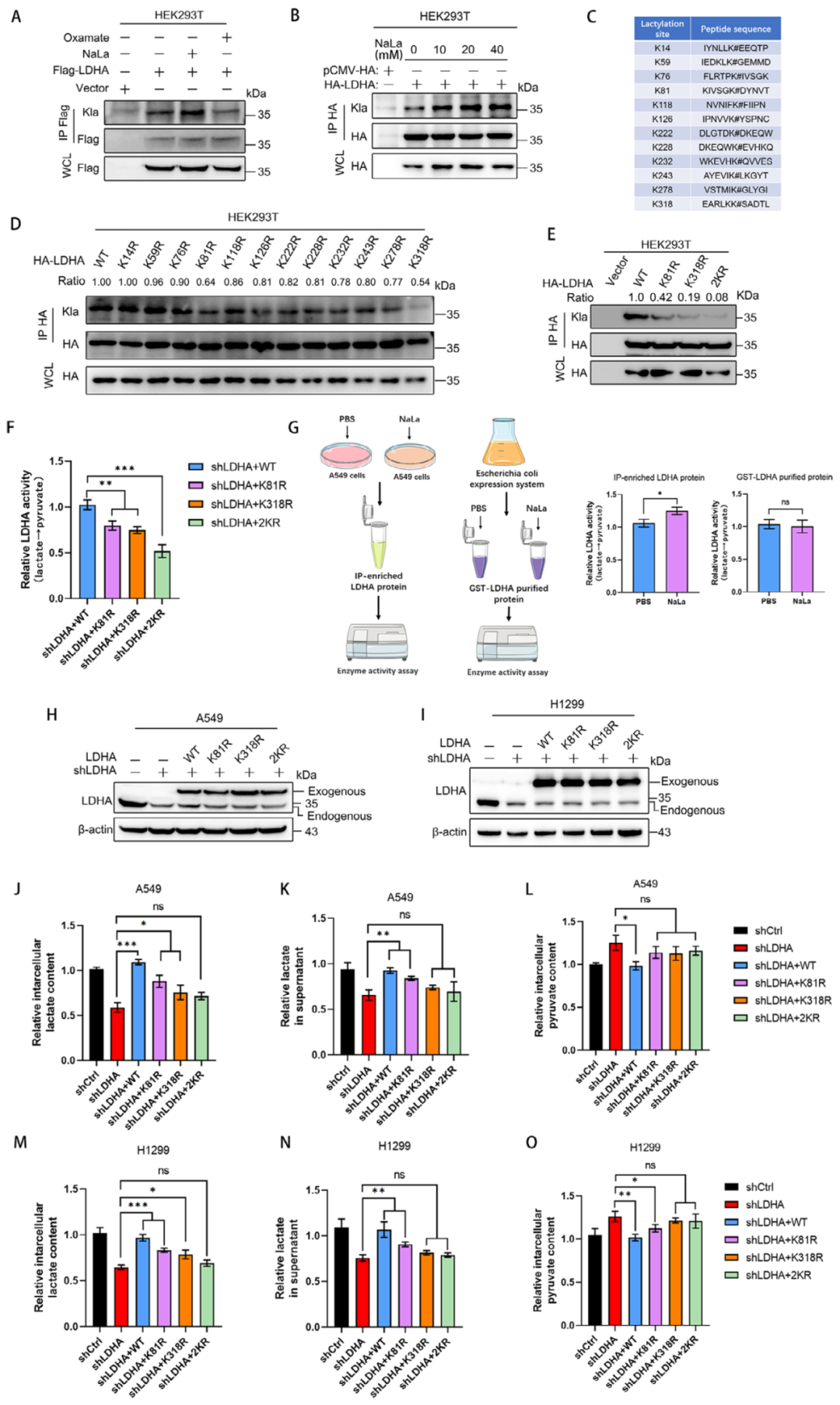
图3. LDHA的乳酸化对其酶活性的维持至关重要
三、乳酸化修饰的调控机制:AARS1和SIRT2的动态平衡
接下来,研究团队开始探索LDHA乳酸化修饰的调控机制。他们首先筛选了已知的乳酸转移酶,发现p300虽然能促进整体乳酸化,但对LDHA的乳酸化没有影响。进一步研究发现,丙氨酰-tRNA合成酶1(AARS1)才是介导LDHA乳酸化的关键酶。实验证实AARS1能与LDHA直接结合,并促进其乳酸化修饰。当AARS1被敲除后,LDHA的乳酸化水平显著下降。更重要的是,研究人员还发现SIRT2作为去乳酸化酶,能够去除LDHA的乳酸化修饰,这表明乳酸化修饰处于动态平衡中。
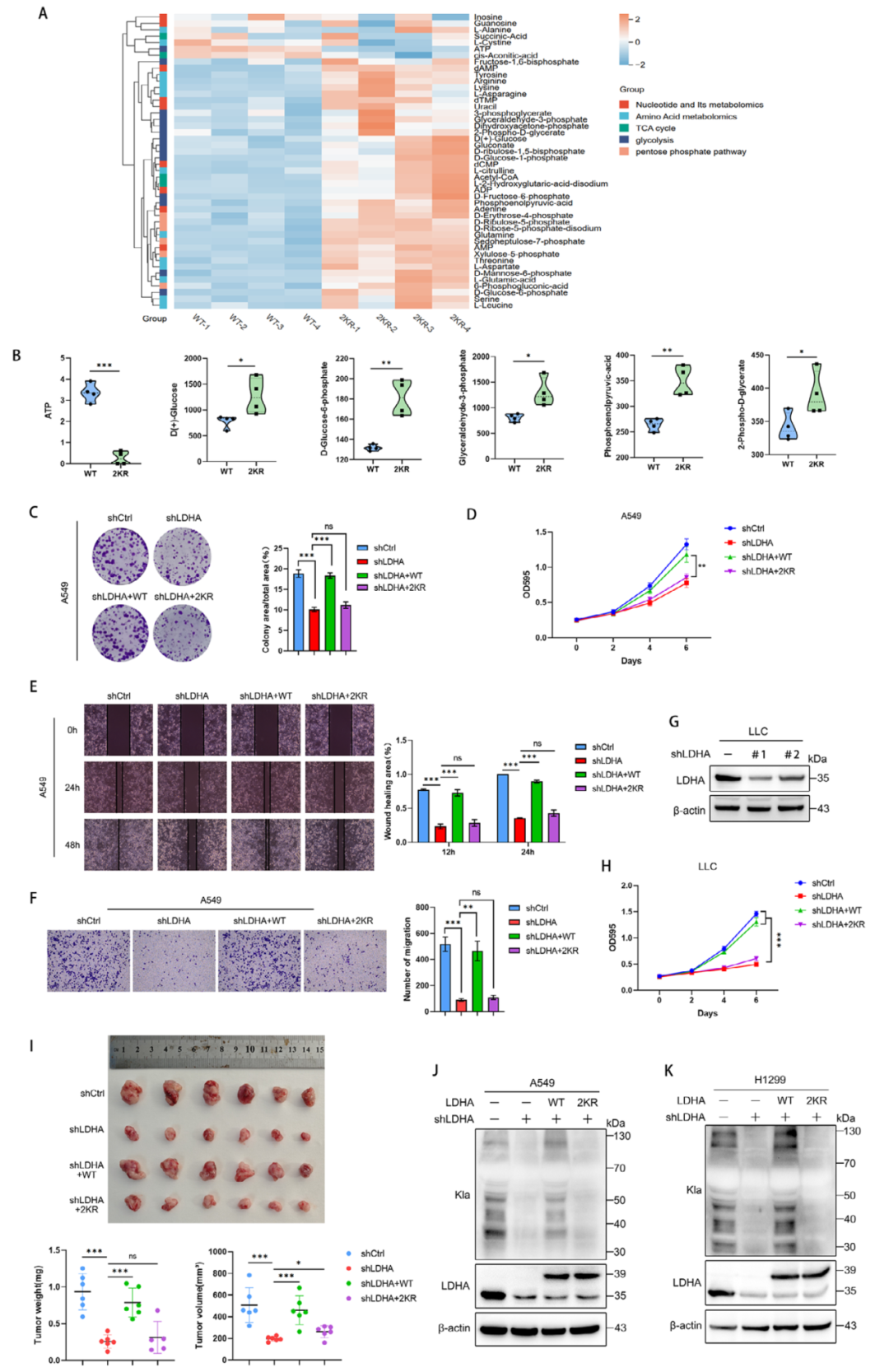
图4. LDHA乳酸化的缺失会削弱其致癌能力
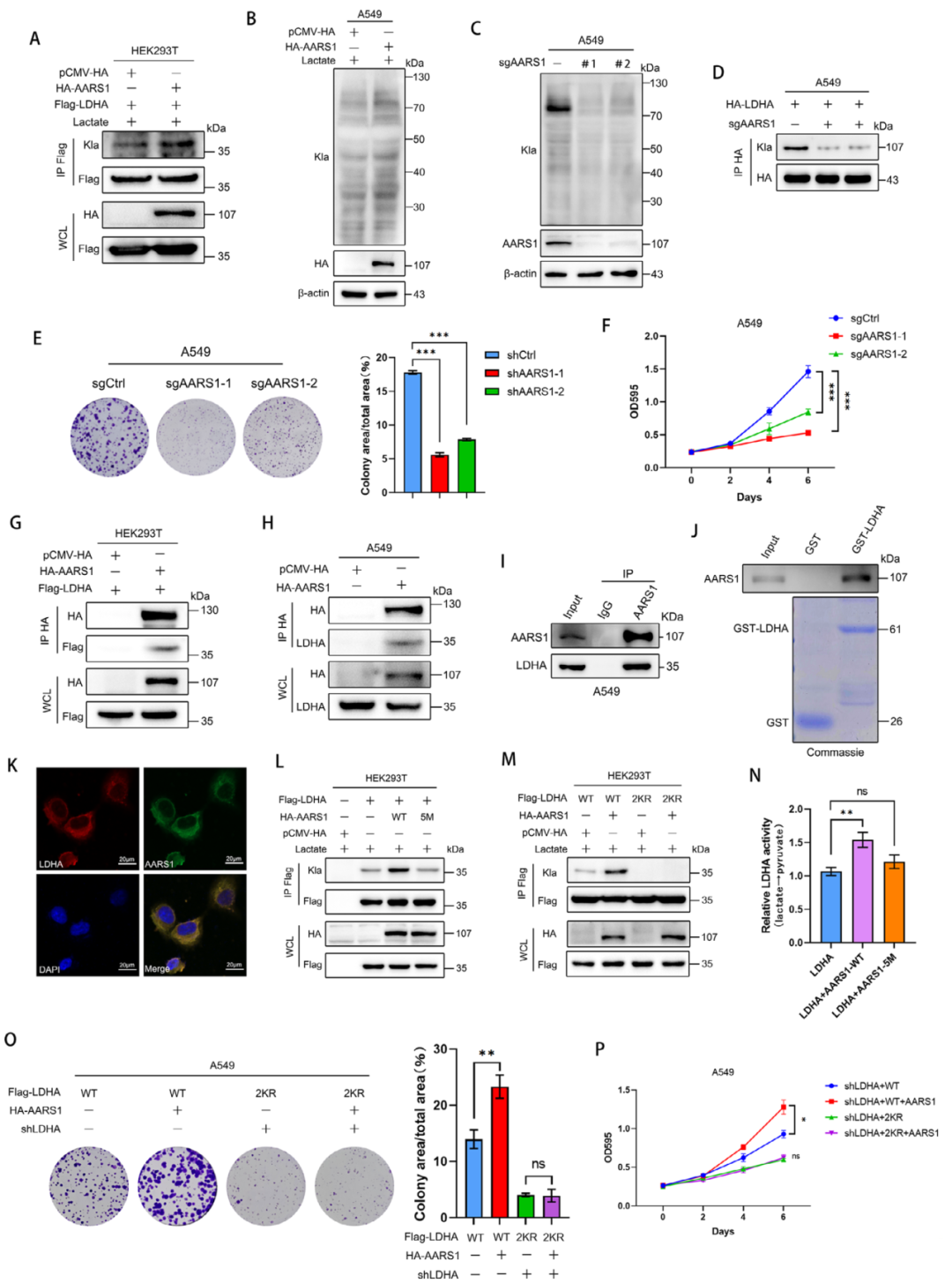
图5. AARS1作为LDHA的乳酰转移酶可增强其酶活性
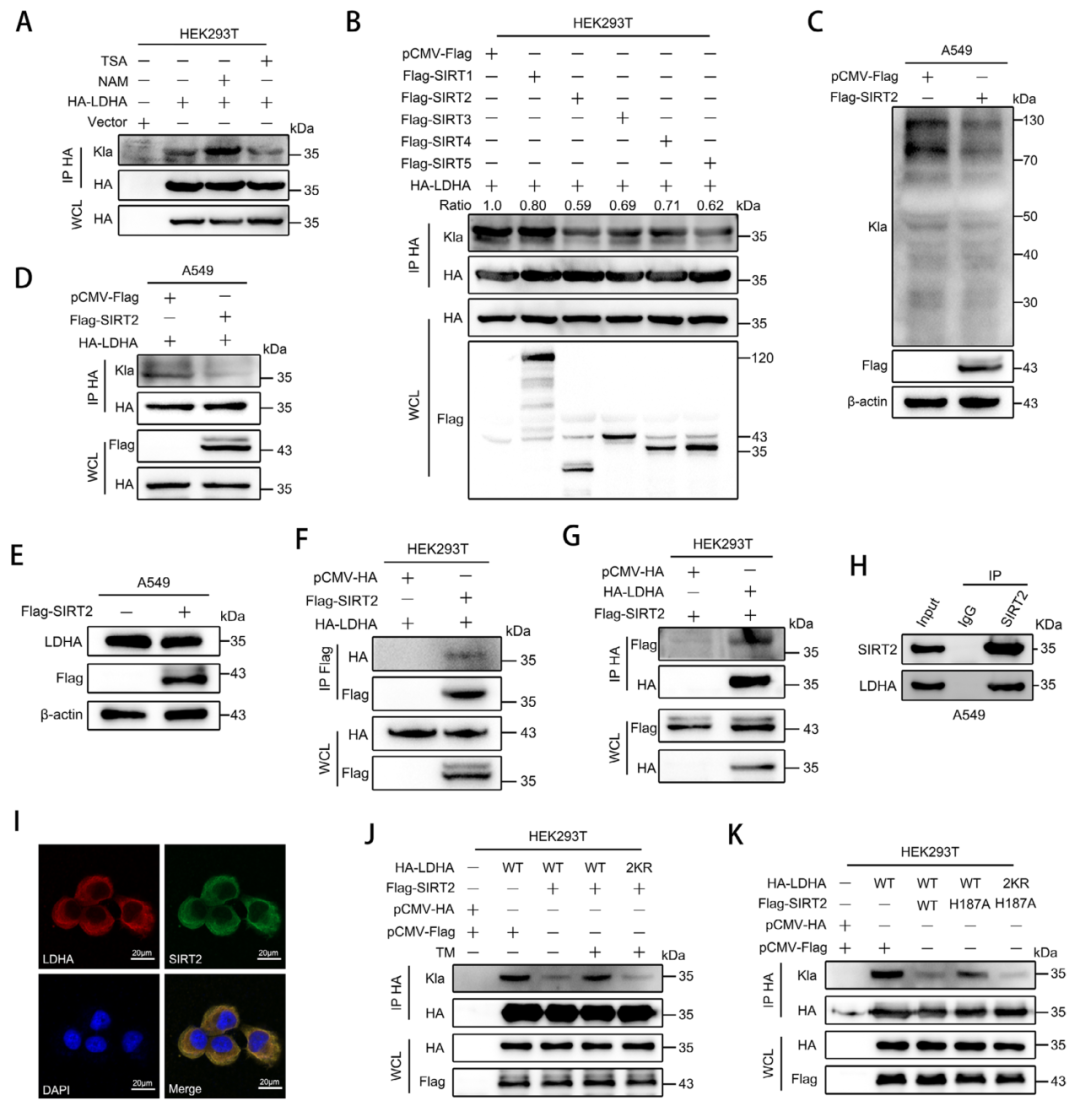
图6. SIRT2 是肺癌中LDHA乳酸化的Eraser
四、功能验证:乳酸化是LDHA帮助肺癌生长的关键因素
在阐明机制后,研究团队开始验证LDHA乳酸化的生物学功能。他们发现,与野生型LDHA相比,LDHA-2KR突变体无法有效促进糖酵解和ATP生成,这表明乳酸化对LDHA的致癌功能至关重要。细胞功能实验进一步显示,LDHA-2KR突变体无法像野生型LDHA那样促进肿瘤细胞增殖和迁移。动物实验也证实了这一发现:移植了表达LDHA-2KR的Lewis肺癌细胞的小鼠,肿瘤生长速度明显慢于移植野生型LDHA的小鼠。
研究的最后部分聚焦于LDHA乳酸化的临床意义,特别是其对化疗耐药的影响。研究人员通过乳酸化修饰组学分析,发现多个参与非同源末端连接(NHEJ)DNA修复的蛋白可能受乳酸化调控,包括FEN1、XRCC5和XRCC6。实验结果表明,乳酸化能促进FEN1-RAD1-RAD9A-HUS1复合物的形成,这是NHEJ修复的关键步骤。当研究人员抑制乳酸化时,DNA损伤修复效率下降,肿瘤细胞对顺铂的敏感性增加。更重要的是,他们发现FEN1的K345是关键的乳酸化位点,该位点的突变会显著影响其与DNA修复适配分子的相互作用。这为理解乳酸化如何调控DNA修复提供了分子基础。这些结果不仅证实了LDHA乳酸化在肿瘤发生中的重要性,还揭示了一个正反馈调控回路:乳酸化增强LDHA活性,促进乳酸生成,进而进一步提高整体乳酸化水平。
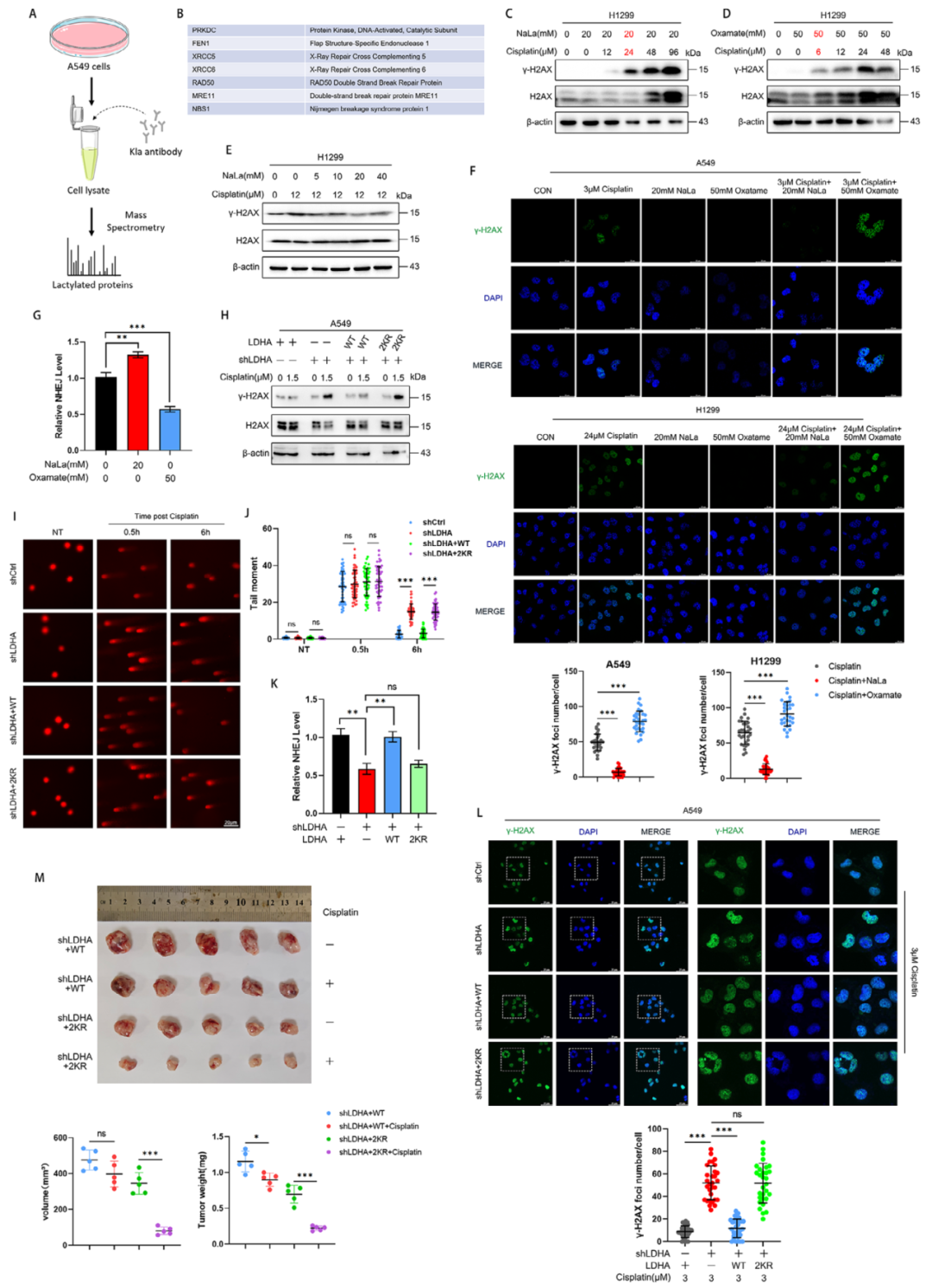
图7. LDHA通过调节蛋白总体乳酸化水平影响顺铂诱导的DNA损伤反应
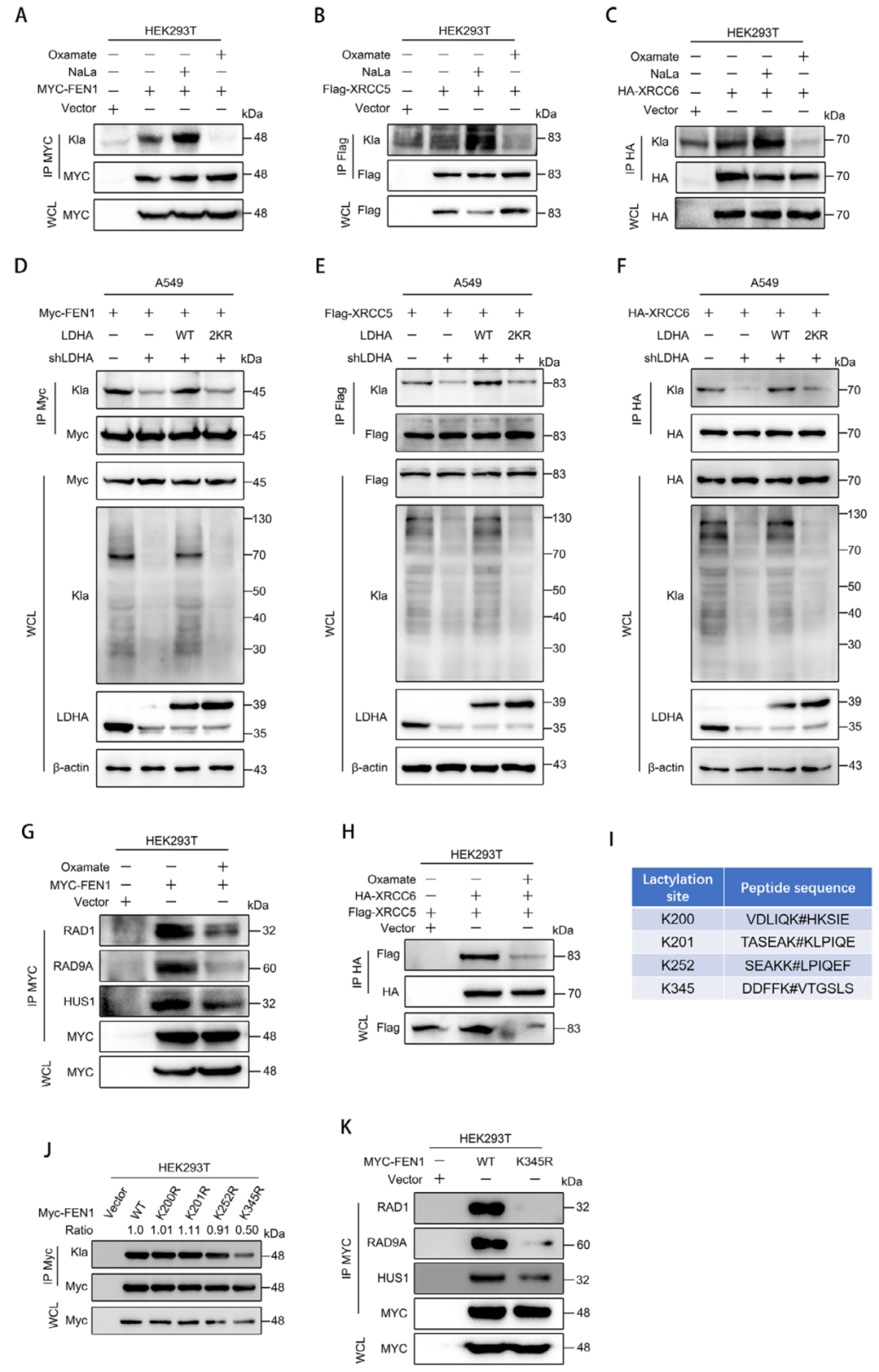
图8. LDHA通过调节蛋白总体乳酸化水平影响DNA损伤修复
研究总结与展望
总体来说,研究首次揭示了LDHA与乳酸化之间的双向调控机制,将乳酸化与DNA损伤修复直接联系起来,阐明了LDHA通过调控NHEJ相关蛋白的乳酸化,增强肿瘤细胞对顺铂的耐药性。且本文的独特之处在于其完整的研究链条——从临床现象出发,逐步深入机制探索,最终回归临床应用。研究团队在每个阶段都设置了合理的研究思路,并通过严谨的实验设计获得了相应的研究结果。
青莲百奥修饰组学解决方案
青莲百奥修饰蛋白组学产品线升级,不仅精心打磨了经典修饰产品线(如磷酸化、糖基化、泛素化等),同时开拓了一系列新型修饰产品线(如乳酸化、棕榈酰化、琥珀酰化、氧化还原等)。现凭借先进的高分辨率、高灵敏度质谱技术,积累了丰富的修饰组学研究经验,提供深入的生物信息学分析报告,为科研工作的深入探索和成果的有效转化提供强有力的支持。

参考文献
Li J, Xun W, Wang X, et al. Lactylation Enhances the Activity of Lactate Dehydrogenase A and Promotes the Chemoresistance to Cisplatin Through Facilitating DNA Nonhomologous End Junction in Lung Adenocarcinoma. Adv Sci (Weinh). 2025 Nov 5:e10733.